
名誉教授/特任教授
松本 和彦
◇背景・概要
近年の新型コロナウイルスのパンデミックは記憶に新しいものがある。従来、パンデミックと言えば、高病原性の鳥インフルエンザウイルスに起因するもので、図1に示す100年前のスペイン風邪に始まり、アジア風邪、香港風邪と多くの犠牲者を払ってきている。これらは〜40年近い周期で生じていた。ところがコロナウイルスのパンデミックは、2003年のSARSに始まり、MERS、今回の新型コロナウイルスと10年以内の周期で次々とパンデミックが生じていることがわかる。これは我々の日常生活にとって極めて高い脅威となるものである。
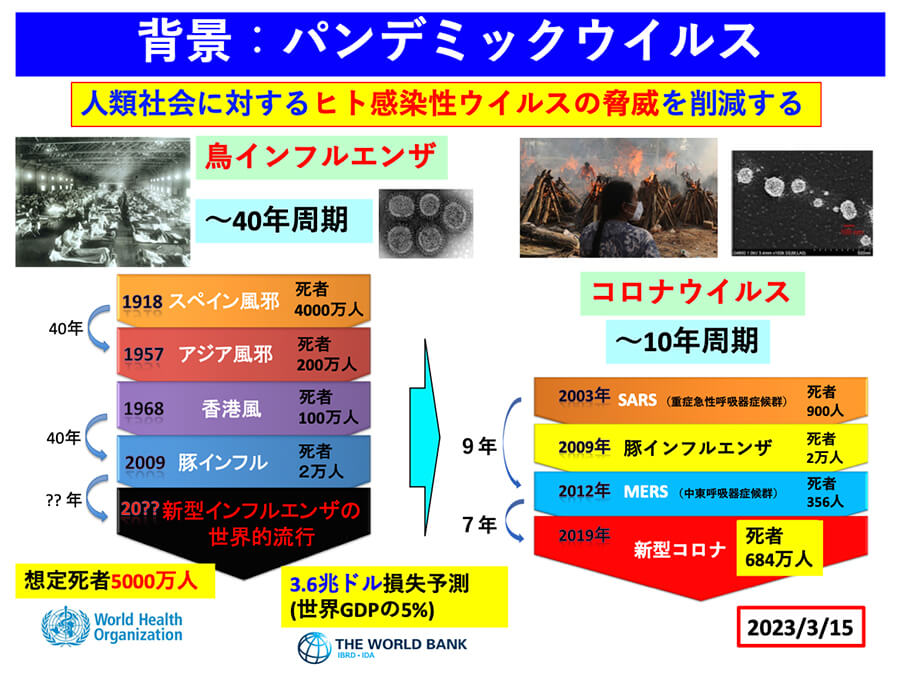
新型コロナウイルスでは700万人近い人が亡くなっている。
これらパンデミックを防ぐには、迅速、高感度なウイルス検出技術が必要不可欠である。すでに様々な検出技術があるが一長一短の感がある。図2に示すように、PCRは極めて高感度であるが、検査時間が〜1時間以上と長く、かつ高額で、専門の検査技師が必要である。またイムノクロマトを用いた抗原検査キットは安価でわずか15分で検査でき、素人でも可能な簡便さであるが、感度が不十分であり、新型コロナウイルスの検査でも問題になったように、偽陰性、偽陽性の結果を出してしまうことがあり、信頼性にかける。本研究では、グラフェンFETの高感度特性を利用し、高感度であり、かつ高速、簡便に計測できるシステムを開発する。
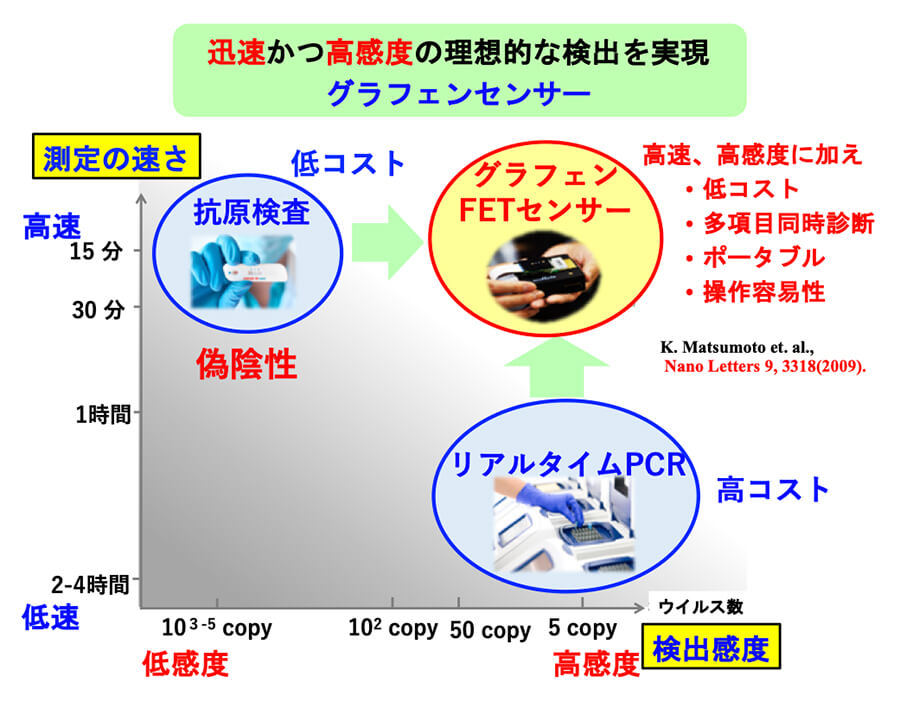
◇グラフェンFETセンサによるウイルス検出
図3にグラフェンの特長を示す。グラフェンは、伝導体と価電子帯が線形の分散関係を示す特殊な半導体であり、その有効質量はほぼ0に近い。その為、従来のシリコン半導体の移動度の1000倍近い200,000cm2/Vsという驚くべき実験結果が示されている。またグラフェンの表面にはπ電子で形成される2次元電子ガス(電子が海のように広がっている)が表面に露出している。その為、グラフェンの表面に電荷を有するものが近づくとグラフェンの電気特性が大きく変化する為、高感度が得られる。図3に示すように、グラフェンの表面にウイルスを選択的に補足するレセプター(抗体や糖鎖)を修飾し、電荷を持ったウイルスが溶液中でレセプターに捕捉されると、ウイルスの電荷によりグラフェンの電気特性(ドレイン電流やディラックポイント)が変化する。この変化によりウイルス検出する。
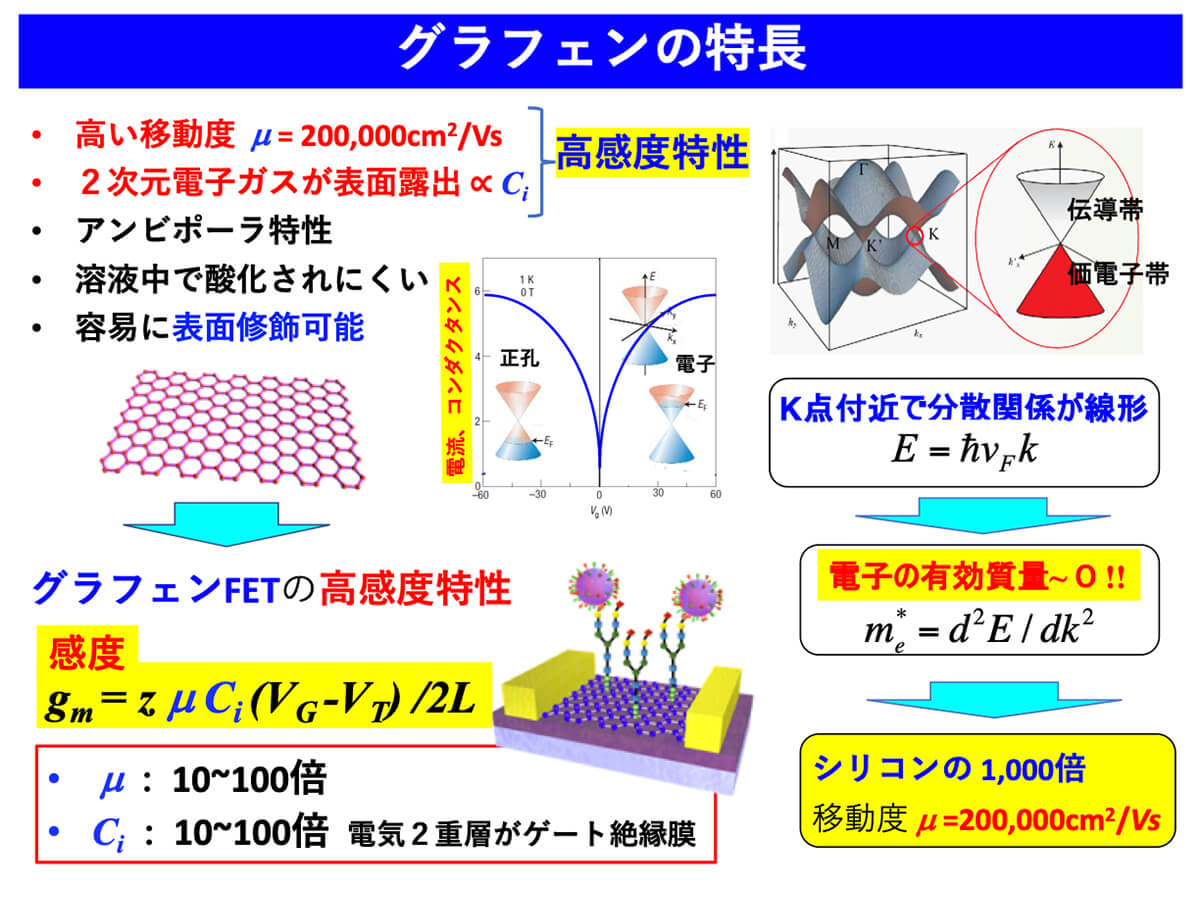
また2次元電子ガスが表面に露出しているため、高感度特性を示す。
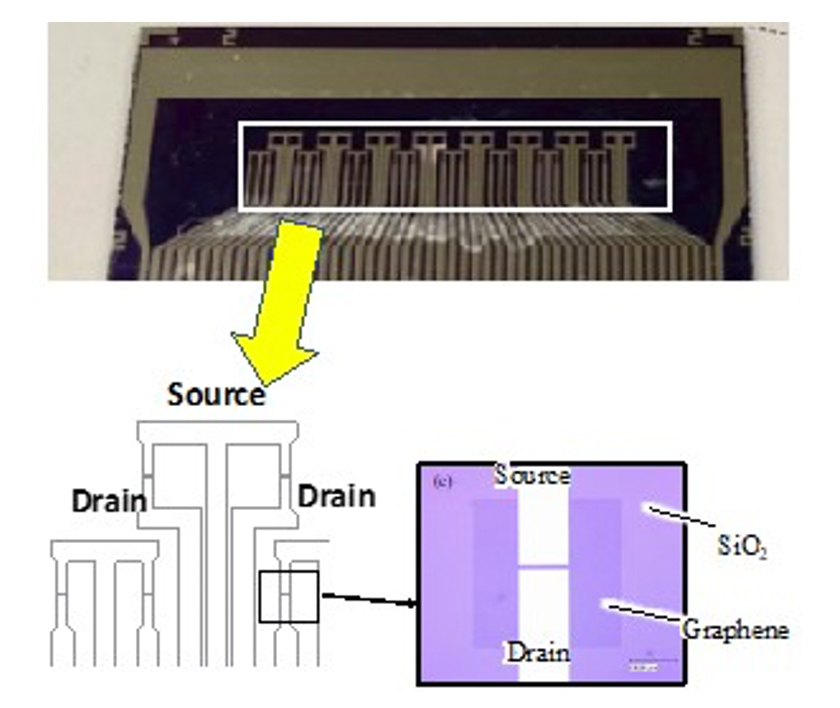
図4はSi/SiO2基板上に集積された32個のグラフェンFETの光学写真である。その模式図と一個の拡大したグラフェンFETの写真を示す。FETのチャネル長は10μm、チャネル幅は100μmである。このFETアレイの左側半分には抗体を修飾してウイルスを選択的に検出し、FETアレイの右側半分は抗体を修飾しない参照FETとした。
さらに従来は、ピペットを用いて導入、排出していたリン酸緩衝生理食塩水(PBS)を自動送液する為に図5に示すマイクロ流路をグラフェンFETアレイ上に形成し、PBSを右の流入口から左の排出口に導入する手法を確立した。これにより再現性が向上した。このマイクロ流路に送液するために、コンピュータ制御のマイクロポンプシステムを形成し、これにより、PBSによる洗浄、溶液交換を定量的に、かつ再現性良く行うことが可能となった。

上記に示すマイクロ流路測定システムを用いて図6に示す新型コロナウイルスの計測を行った。グラフェンFETアレイの左側13個のFETにはPBASE (1-Pyrenebutyric acid N-hydroxy-succinimide ester)を介して新型コロナウイルス(SARS-CoV-2)のスパイク抗体が修飾され、図6で赤いラインがその13個のFETのディラックポイントの平均値を示す。またグラフェンFETアレイの右側13個のFETには抗体を修飾せず、参照FETとし、図6で緑のラインがその13個のFETのディラックポイントの平均値を示す。赤と緑のディラックポイントの差はグラフェンに修飾された抗体とPBASEの電荷によるものである。ウイルスは抗体と体内の生理食塩水濃度である1xPBS(150mM)でもっともよく抗体と結合する。しかし1xPBSにおけるデバイ長は0.7nmであり、抗体の~10nmのサイズよりはるかに小さい。このため1xPBSにおいては、ウイルスが抗体に結合してもウイルスの電荷は電気2重層の電荷により遮蔽されて検出することができない。そこで我々は電荷を検出する際はPBS溶液を0.01xPBSに交換し、デバイ長を7nmと延伸させることにより、ウイルスの電荷をグラフェンFETで検出することに成功した。この溶液交換法を用いて新型コロナウイルスを計測したのが図6である。Tween20によるブロッキングの後、ウイルスの入っていない1xPBS溶液を2回導入している。これは溶液交換により、ディラックポイントに変動が生じないかを確認するものである。図6からわかるように溶液交換によるディラックポイントの変動は極めて小さいと結論づけられた。1×108FFU/mLの濃度の新型コロナウイルスを含む1xPBS溶液を導入後、0.01xPBS溶液を導入してディラックポイントの変化を測定すると、図6右端の黄矢印に示すように、基準値を示す赤の一点鎖線よりディラックポイントが上むきに変化していることがわかる。これが新型コロナウイルスの電荷を検出した結果である。この変化について以下に詳細に検討する。
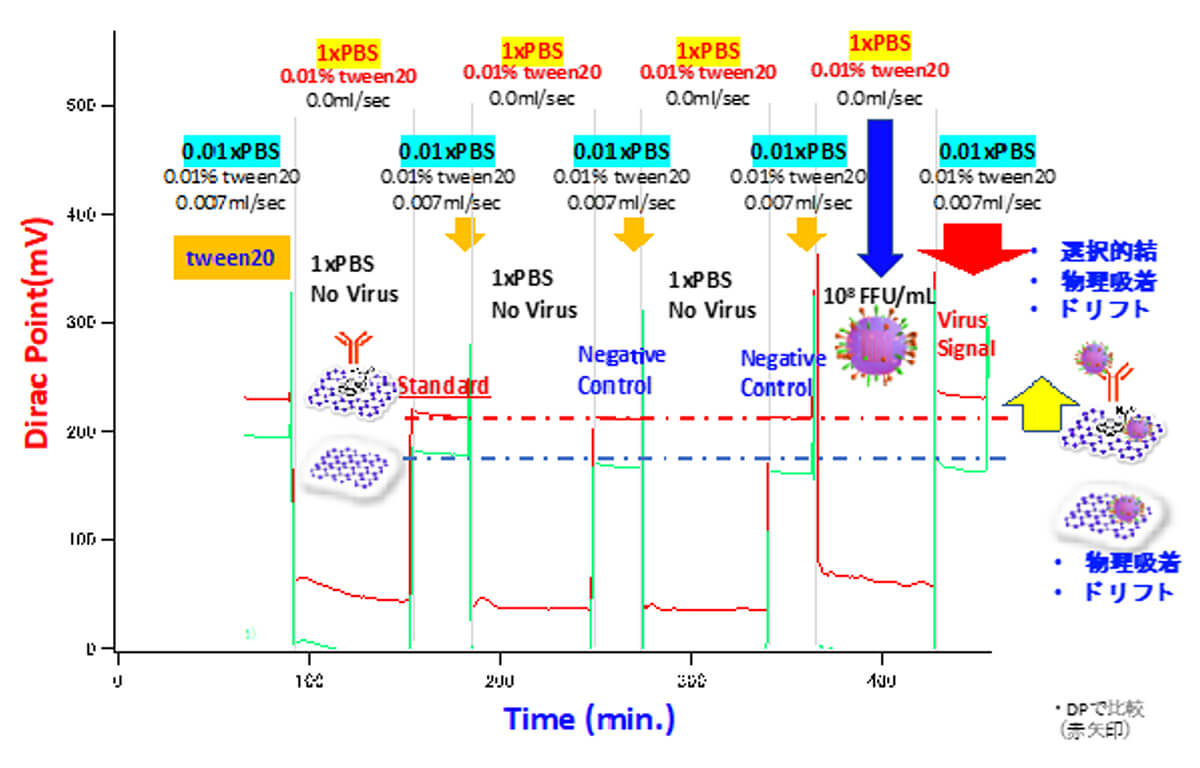
図6の特性は13個のFETの平均値を示したものである。これらの個々のFETのディラックポイントの分布を詳細に解析する。図7は抗体の修飾されたグラフェンFET(左側)と抗体の修飾されていないグラフェンFET(右側)のそれぞれのディラックポイントの分布を示す。横軸はFETのナンバーリングである。青いラインは新型コロナウイルス導入前、赤いラインは導入後の値である。ウイルス導入前のディラックポイントは、抗体のある、無しで~40mV前後の差がある。これは抗体の電荷によるものと考えられる。ウイルス導入後、抗体のある領域ではディラックポイントは〜20mV近く大きく増加する。これに対して抗体のない領域は、ほとんど変化しないことがわかる。この両者のディラックポイントの変化分ΔVDP図8に示す。
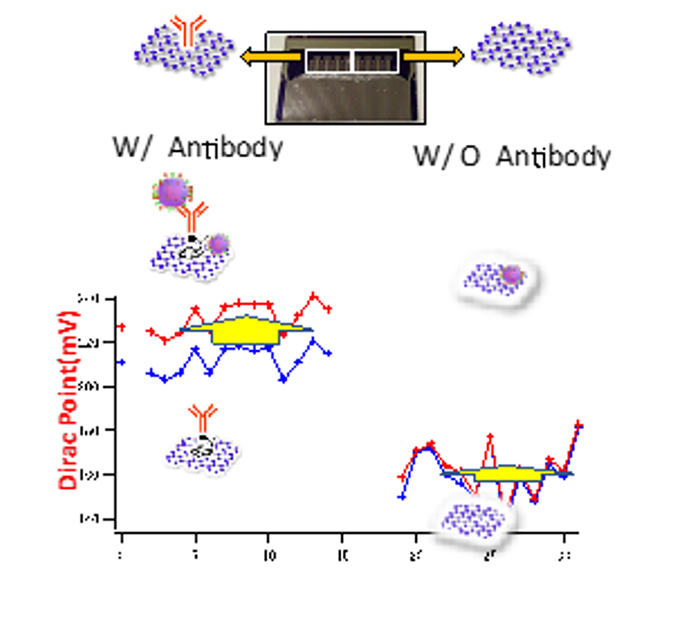
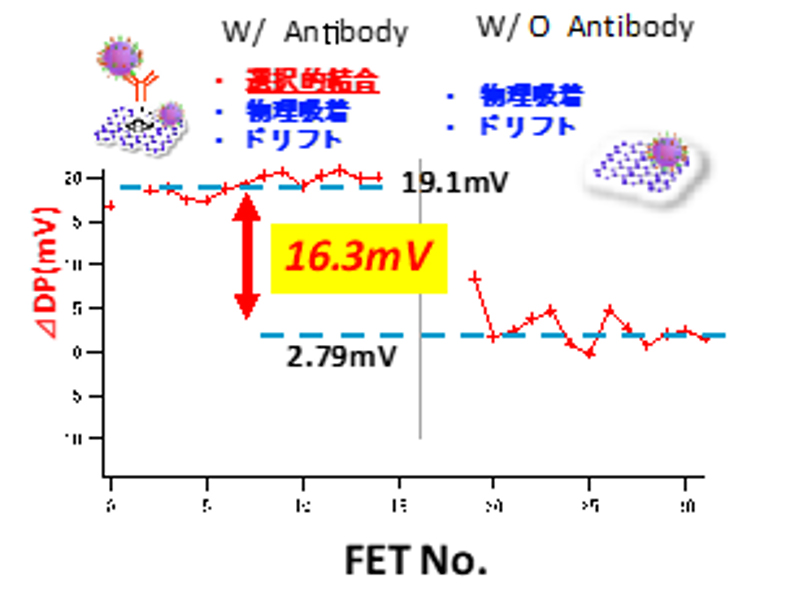
図8の左側は抗体を修飾したもの、右側は抗体を修飾していないものである。抗体を修飾したFETではウイルスの導入前後で平均ΔVDP =19.1mVの大きなディラックポイントの変化が得られている。この変化は、抗体に選択的に結合したウイルスと、グラフェン上に物理吸着したウイルス、およびベースラインのドリフトに由来する。これに対して抗体を修飾していないFETでは平均ΔVDP =2.79mVの極めて小さな変化が生じた。この変化はグラフェン上に物理吸着したウイルス、およびベースラインのドリフトに由来する。したがってこれら二つのディラックポイントの変化分の差19.1mV-2.79mV=16.3mVは、ドリフトや物理吸着の影響を除いた、抗体に結合した新型コロナウイルスの電荷にのみよる変化であると結論づけられる。以上のように、参照FETによる信号を差し引くことにより、極めて正確に抗体に結合したウイルスの電荷のみを測定する手法を確立した。
次回に続く-
【著者紹介】
松本 和彦(まつもと かずひこ)
大阪大学産業科学研究所 名誉教授、特任教授
■略歴
- 昭56.3東京工業大学大学院博士課程電子物理工学専攻修了 工学博士
- 昭56.4電子技術総合研究所
電子デバイス部 固体デバイス研究室 入所 - 昭63〜平2スタンフォード大学電気工学科 客員研究員
- 平 5.7電子デバイス部 微構造エレクトロニクス研究室 室長
- 平13.4産業技術総合研究所 総括研究員
- 平15.3大阪大学 産業科学研究所 教授
- 平24.4〜26.3大阪大学 産業科学研究所副所長
- 平25.10〜大阪大学COI研究推進機構 副機構長・研究統括リーダー
- 平30.3大阪大学定年退官、名誉教授、特任教授
■受賞
- (1)平成 8年度科学技術庁長官賞 研究功績者表彰
- (2)平成 8年度国際固体素子材料コンファレンス 最優秀論文賞
- (3)平成10年度第30回 市村学術賞 功績賞
- (4)平成10年度第57回 科学技術庁 注目発明選定
- (5)平成11年度第12回 工業技術院長賞
- (6)平成13年度国際固体素子材料コンファレンス 最優秀論文賞
- (7)平成20年度応用物理学会フェロー表彰
- (8)平成23年Micro Nano Process Conference 2010 Award Outstanding Paper
- (9)平成24年Micro Nano Process Conference 2011 Award Outstanding Paper
- (10)平成25年, 26年, 27年 大阪大学総長表彰
