千葉大学大学院医学研究院の田中知明教授と、コロンビア大学のCarol Prives教授の国際共同研究チームは、がんの転移に働く遺伝子発現の新しいメカニズムを解明した。
がん抑制遺伝子産物p53を抑制することが知られているタンパク質であるMdm2が、p53との関係とは独立して、Sprouty4(※1)の制御を介してがん細胞の遊走(※2)や浸潤、接着斑(※3)の形成を促進し、がんの浸潤や転移を促進するメカニズムを明らかにした。このように、がんの転移に関わる因子の解析が進むことで、がんの新たな治療法の開発が期待できるという。
本成果は、英国科学誌Nature Communicationsに2024年8月20日に掲載された。
■研究の背景
潜在的ながん遺伝子(産物)として報告されているMouse Double Minute 2(Mdm2)は、p53と結合し、p53の活性を制御するのに重要な役割を担うことが知られている。Mdm2は、単独あるいはMdm2と似た機能や構造を持つMdmXと複合体を形成し、p53を分解に導く。Mdm2とMdmXはともに多くの腫瘍で過剰発現しており、Mdm2はDNA修復、細胞生存や増殖、細胞の遊走の調節、転移の促進など腫瘍の形成に関わる多くのプロセスを制御することが示されていた。
しかし、Mdm2による細胞の遊走調節の仕組みは十分に明らかにされていない。しかも、これまでの多くの研究では、細胞遊走の解析は野生型あるいは変異型p53を持った細胞株を用いて行われていて、細胞遊走に変化が生じてもp53による細胞応答への影響を受けてしまうという問題があった。
■研究の成果
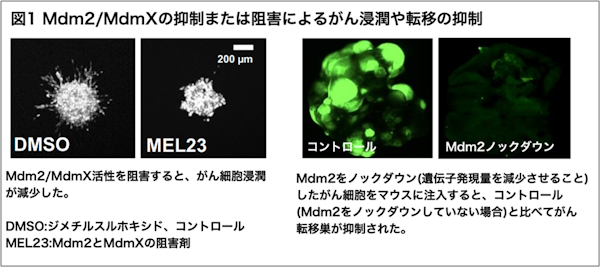
研究チームは、p53を欠失したヒト線維肉腫とヒト肺がんの細胞株を使ってMdm2やMdmXの発現抑制や、阻害剤を用いたMdm2の機能阻害を行ったところ、2Dモデルおよび3D腫瘍スフェロイドモデルにおいてMdm2/MdmXの機能阻害が細胞の遊走やがん細胞の浸潤、転移を抑えることを示した(図1)。そのメカニズムを調べると、Mdm2の発現抑制や機能阻害により接着斑の数とサイズが減少すること、細胞の遊走や細胞外マトリックス(※4)との相互作用に関連したプロテオーム(※5)が変化することが示された。
さらにここで変化したタンパクについて調べたところ、Mdm2/MdmXがSprouty4の発現や体内での移動に悪影響を与えていること、Mdm2が接着斑の形成と転移を促進するにはSprouty4の発現を抑制することが必要であり、Sprouty4による細胞遊走の制御にはRhoA(細胞骨格、接着、運動を調節する分子)の抑制を介することが明らかとなった。
■今後の展望
本研究により、Mdm2がp53とは独立してがんの転移を促進する仕組みを明らかにした。臨床試験中のMdm2阻害剤の多くは、Mdm2とp53を解離させる薬剤を用いて、野生型p53を持つ腫瘍をターゲットとしている。一方で、がんの半数以上はp53に変異や欠失があり、これらのMdm2阻害剤の有効性は一部の腫瘍に限られる可能性がある。本研究の結果は、p53を欠失した変異型p53の腫瘍の治療にも有効であることが示唆された。今後は、これらの分子をターゲットにした新規治療法の開発が期待されるという。
■用語解説
※1) Sprouty4:さまざまなシグナル伝達経路を調節する役割を果たすタンパク質。細胞の異常な増殖や分化を防ぐ重要な役割を持ち、これまでがん細胞の遊走を抑えることは報告されていたが、Mdm2との関わりは報告がなかった。
※2) 細胞遊走:細胞が生体内のある場所から別の場所に移動すること。がん細胞の遊走により、移動した臓器や組織で増殖するとがんの浸潤や転移につながる。
※3) 接着斑:細胞と細胞外基質が接着する場所。細胞の細胞外基質への接着は、主としてFocal adhesionと呼ばれる細胞表面の特定の構造で起きていて、細胞内の細胞骨格タンパクが細胞表面のセンサー分子、インテグリンを介して細胞外基質と連結する。
※4) 細胞外マトリックス:細胞の周囲に形成される線維状あるいは網目状の構造体のこと。細胞の物理的足場となるだけでなく、細胞と相互作用することで細胞の増殖や細胞間の情報伝達を制御する。
※5) プロテオーム:生体内のタンパク質の網羅的な解析の産物。
プレスリリースサイト(chiba-u):https://www.chiba-u.ac.jp/news/research-collab/mdm2.html