
教授 檀 一平太
1.fNIRSとは?
光を頭の上から照らして,跳ね返ってきた光から脳の活動を読み取る-そんな夢のような方法がfNIRSである。省略なしの名称は,functional Near-InfraRed Spectroscopy(機能的近赤外分光分析法)で,頭文字をつなげて,エフニルスとよぶ。
fNIRSによる脳機能の計測は,大がかりな計測器や特別のスペースを要するわけではない。fNIRSの本体は,ハイエンド機種でも小型のコピー機程度のコンパクトさである。押せばキャスターで動き,日常的な環境ならばたいていの場所で使用することができる。生体に影響をおよぼすことなく,非侵襲的に脳機能の計測ができる。ハイエンドの多チャンネル機であれば,大脳の広い領域をカバーすることも可能である1,2)。
fNIRSの計測はとても簡単だ。頭の上に帽子のような測定器をかぶるだけで,脳のはたらきを見ることができる(図1)。帽子の内側には,光を送る送光器と光を受け取る受光器が互い違いに並んでいる。帽子から送られてきた信号は,コンピュータの画面にリアルタイムで映し出される。線グラフとして。あるいは,脳の活動を表すマップとして。

日常的な環境での計測が可能で,被験者の負担も少なく,比較的自由に実験課題を設定できる。
たとえば,右手を開いたり閉じたりを繰り返すと,左耳の上あたりのマップが赤く光る。大脳左半球の運動野で神経が盛んに活動して,脳の血流が増えているためである。あるいは,つぶやきながら一人でしりとりを始めると,左側のこめかみの上あたりのマップが光り出す。言語の生成をつかさどるブローカ野の活動が高まったためである。このように,現実に起こっている行動が,脳の活動として表される。fNIRSを通して,われわれは現実世界の背景に存在する脳内表象を垣間見ることができるのである。
一見,fNIRSは脳機能を簡便に計れる夢の機器のようにも思える。実際,脳を測るという想いを抱きつつ,われわれの研究室を訪れる客人は多い。fNIRSで「食品のおいしさをはかりたい」,「消費者の好みをはかりたい」,「商品の心地よさをはかりたい」といった具合に,夢の活用プランを熱心に語ってくださる。しかし,もうしわけないことに,夢を打ち砕いてしまうというケースがほとんどである。とはいえ,われわれの研究室はfNIRSに関する共同研究の成功率が高い方で,「ADHD(注意欠如多動症)の治療効果の評価」3),「運動が認知機能におよぼす影響の評価」4),「ファンデーションの価値評価」5)など,日の目を見た共同研究もある。では,fNIRS研究の成功と失敗を分ける違いはなんなのだろう?その答えは,fNIRS計測の特徴と限界を知り,適切に使用するという,いわば当然の解答である。いくつかの重要な点に的を絞り,解説をこころみていく。
2.fNIRSは大脳の外側しか計れない。
fNIRS計測では,頭の上においた送光器から脳に向かって近赤外光を照らす。ただし,最近は赤色光もよく使われる。波長の長い光は生体への透過性がよく,散乱と反射を繰り返しながら,皮膚を超え,頭蓋骨を超え,脳脊髄液と硬膜を超え,脳組織まで届く(図2)6)。脳組織には血管が張りめぐらされている。血液に含まれるヘモグロビン分子は光をよく吸収する。しかし,吸収されなかった光のうち,一部は脳組織から反射と散乱を繰り返し,頭皮に戻ってくる。このとき,脳活動が盛んになって血流量が増えると,光は多く吸収される。このため,頭皮に戻ってくる光の量も減ることになる。この変化をモニタリングすることによって,脳組織中の血流量の変化がわかるわけである7)。
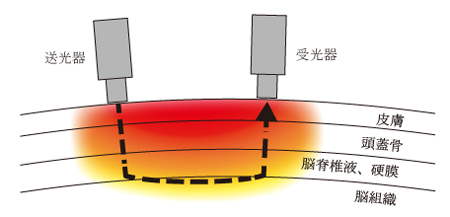
受光器で検出される光が生体組織をどのように通過するかを示している。赤色が濃いほど,通る光量は多い。点線は,脳組織を通る光路の典型的な例を示している。文献6を基に作成。
では,光はどのくらいの深さまで通るかと言うと,実は,脳の表面にしか到達しない。そもそも,脳組織は表面が灰白質,内部が白質というように,白っぽい色をしている。白は光を反射するから白いということを考えれば,脳組織に光が通りにくいということは,想像に難くない。実際,慶應大の岡田英史教授らが行なった光伝播のシミュレーションによると,光は脳の表面を主に通ることが明らかになっている。送受光器の間隔を広げても,光はあまり深くには行かず,脳組織の表面を這うように進んでいく6)。
脳からの信号を運ぶ光の特性を考えると,fNIRSでは脳の深部の活動が計れないことは明らかである。したがって,大脳皮質の深部や,大脳辺縁系の活動は計ることができない。たとえば,快不快の中枢である扁桃体や,報酬系の中枢である線条体,記憶整理の中枢である海馬などの脳血流変化はfNIRSではとらえられない。となると,好き嫌い,気持ちよさ,既知か否かといった情報を,脳の信号としてfNIRSから読み取ることは困難である。
このような場合,研究上の問いを,fNIRS計測の土俵に持ってくるという工夫が必要になってくる。たとえば,われわれは資生堂との共同研究で,化粧の下地となるファンデーションの評価に関わる脳活動をfNIRSで計測した5)。単純な好き嫌いに着目した場合,fNIRSは絶望的なツールにしかなりえない。そこで,われわれはファンデーションの価格判断に着目した。
過去のfMRI(機能的核磁気共鳴撮像法)研究では,大脳皮質の外側にある右前頭前野の背外側部が価格判断に関係した領域であることが分かっている8)。なお,fMRIは磁気を用いて血流変化の計測ができる装置である。fNIRSと違って脳全体を測ることができるが,機械が大がかりで,騒音が多く,動きに弱いという欠点もある。
fMRI研究を参考にして,ファンデーションを塗布した後,価格判断をする際の脳血流変化をfNIRSで計測した。各個人ごとにファンデーションの価格評価は異なるので,脳血流変化との相関係数を算出した。個人間で安定的に相関の高い脳領域を調べたところ,右前頭前野の背外側部が関与していることを見いだした6)。このように,fNIRS研究においては,研究上の問いをそのまま解くより,fNIRSで解きやすい問題にすり替えるということが有効な場合が多々ある。
あるいは,fNIRSが得意な分野に研究対象を持っていくというアプローチもある。たとえば,成人の頭部というのは頭蓋骨が発達していて光が通りにくいが,乳幼児の頭部は光が通りやすい。また,fMRIのスキャナーの中に乳幼児を連れて行くの困難であるが,fNIRSを乳幼児の頭に装着して脳機能を測るということは”比較的”簡単である。ここで強調したのは,あくまでも比較上の問題であって,実際の乳幼児計測はかなり難易度が高い。日本の場合,日立製作所と島津製作所というfNIRSメーカーが早くから計測サポートに力を入れたという歴史もあって,乳幼児研究は盛んである。東京大の多賀研,開研,慶應大の皆川研,中央大の山口研など,国際的にも有力な研究室が多い。
3.fNIRSは2種類のヘモグロビン濃度「由来の信号」を測る
これまでは,ざっくりと脳の血流量変化と記載したが,実際にはfNIRSは酸素化ヘモグロビン(OxyHb)と脱酸素化ヘモグロビン(DeoxyHb)の濃度変化を信号としてとらえる。fMRIは両者が合わさって生じるBOLD信号の計測しかできないので,ヘモグロビンの分離計測はfNIRSのメリットでもある。
2種類のヘモグロビン濃度変化は生理的には異なる意味を持つ。脳のある領域で局所的に神経活動が増えると,代謝が活発になるため,酸素消費量が増える。このためOxyHb濃度が減少し, DeoxyHb濃度が上昇する7)。これは数百ミリ秒〜1秒程度で起こる比較的速い反応で,図3のように信号変化として観察できることもある。このままでは脳組織は酸欠状態に陥ってしまうが,その後,神経活動の興奮を,グリア細胞の一種であるアストロサイト(星状細胞)が感知し,毛細血管を拡張するという神経血管連関という仕組みを通して,血流速度と血流量が増加する9)。OxyHbを多く含む動脈血が流れ,神経の代謝でdeoxyHbが増えた静脈血が洗い流されるので,OxyHb濃度が大幅に上がり,DeoxyHb濃度は減る(図3)。この反応は,神経の興奮から数秒で起こる。fNIRSが測るのは,主にこの遅い方の変化である。
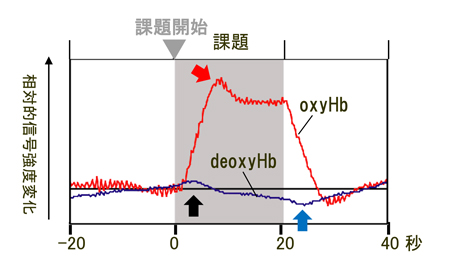
赤線がOxyHbで青線がDeoxyHbの時系列データを表す。課題遂行期間をグレーの背景で示してある。黒矢印はdeoxyHbの初期増加,青矢印はdeoxyHbの減少ピーク,赤矢印はoxyHbの増加ピーク。
一般的には信号強度が強く出るOxyHbを使用することが多いが,解析方法によってはDeoxyHbの方がノイズの影響を受けにくくなることもある10)。両者を積極的に用いて大脳皮質の毛細血管由来の信号を効率的に抽出したり11),体動除去用のフィルターに用いるという用途も提案されている12)。
fNIRSで2種類のヘモグロビン濃度信号変化を計測するためには,2波長以上の光度変化のデータに修正ビア・ランベルト法(MBLL)を用いる13)。ただし,MBLLを厳密に適用するには光が生体を通る光路長の情報が必要である。ところが通常のfNIRSではその計測ができない。時間分解計測法(Time-Domain Spectroscopy:TDS)という特殊な方法を用いれば光路長の計測はできるが1),数チャネルまでの利用にとどまっている。
このため,現実的には光路長が未知のまま計測を行なうという方法が一般的に用いられている。したがって,fNIRSが測定するのは,ヘモグロビン濃度の変化ではなく,ヘモグロビン濃度変化と光路長の積で表されるヘモグロビン信号変化となる14)。定量性の点では妙な気もするが,fMRIで計測されるBOLD信号にヘモグロビン濃度変化に対応する単位はない。脳波の電気信号にも,生理学的に対応する単位はない。
このようなfNIRS計測の制限を考えると,データの取り扱いには注意が必要である。具体的には,異なる領域,異なる被験者間でのヘモグロビン濃度信号値を直接に比較はしないという配慮は必要である。一方で,光路長が近い隣接チャネルの信号値をまとめる,左右半球の対応チャネルの信号値を比較するという処理は問題ない15)。そして,次章で述べるように,このような計測の限界を考慮した上で,統計的に計測信号を扱うということが,脳機能計測の一般的なアプローチである。
4. fNIRSデータの半定量性は統計的処理で解決
光路長情報の欠如によってfNIRSで得られるヘモグロビン信号データは定量的とはいいがたい。とはいえ,同じ被験者の同じチャンネルであれば,信号が増えたか減ったかは半定量的には判断できる。このような半定量的データに対しては,「認知的差分」という手法が有用である。これは,2つの異なる認知的な状態を比較する方法である。たとえば,安静状態となんらかの認知課題遂行時のヘモグロビン信号強度の比較をおこなう。そして,この際の変化量は課題遂行によるヘモグロビン濃度の変化に起因すると考えるわけである。
一般的には,主に2種類の認知的差分法を用いる。ブロックデザインと事象関連デザインである(図4)。ブロックデザインは,ベースラインとタスクといった2つの認知状態が交互に現れるというデザインである。血流反応の変化が数秒を要するので,2つの認知状態は少なくとも10秒程度は空けるようにする。タスクの繰り返しは数回から十数回が一般的で,数種類のタスクを混ぜることもある。
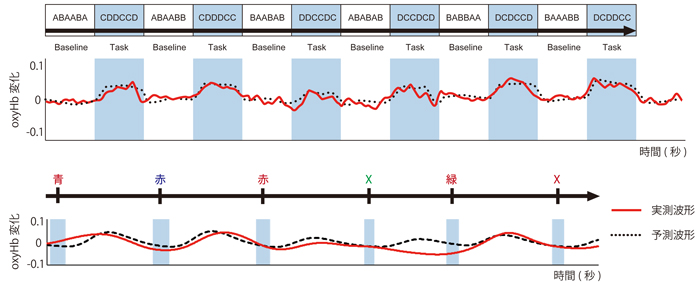
上段はブロックデザインのGo/Nogo課題で, A,D,Cはボタンを押す刺激。Dはボタンを押さない刺激。下段は事象関連デザインのストループ課題で,それぞれの刺激に対して文字の色を答える。青枠は課題の遂行時間。ともに,実測波形およびHRF(脳血流動態関数)とのたたみ込みからの予測波形を示している。本図は文献2から改変。
一方,事象関連デザインは,ベースライン条件の間に1~数種類の事象を生じさせ,脳活動を引き起こす。事象の提示時間が短いので,脳活動変化は小さめになりがちだが,個々の事象と脳活動の関連性を明確に関連付けることができる。
いずれのデザインについても異なる条件間でヘモグロビン信号の差分値を算出し,ある認知状態に対応する脳活動を抽出することになる。脳活動の抽出には,区間平均値を用いるか,時系列データをモデル関数に回帰させ,その回帰係数(β)を求めるのが一般的である10)。これらをファーストレベル解析と呼ぶ。ちなみに,後者は通称GLM(一般線形モデル)解析と呼ばれている。しかし,本来は,モデル関数への回帰分析であって,fMRI研究で用いられた特殊な用語が,そのままfNIRSにも転用されてしまった状態になっている。
通常の実験では,ファーストレベル解析において差分値やβ値が被験者ごとに1セット得られる。これらの値をサマリー統計値と呼び,次に被験者間でt検定や分散分析といった統計的手法で解析する。これをセカンドレベル解析という。このようなプロセスを経て,ある認知状態に対応する脳活動が有意なレベルで大きいか否かを統計的に検証していくわけである。
センシングの分野では定量性が極めて重要な意味を持つが,fNIRSで脳活動を計測する場合には,定量性へのこだわりは得策ではない。計測される信号の曖昧さを許容した上で適切な統計手法を適用するというアプローチが現実的である。一方で計測信号に含まれる曖昧さには,生理的ノイズも含まれる。この点については次章で述べるように別の配慮が必要である。
5.脳以外のシグナル
fNIRSで計測されるヘモグロビン信号は脳活動由来のものだけではない。表皮の上に送受光器を設置する以上,その直下にある皮膚の血流はノイズとして混入してくる(図2)。さらに,全身の血流に伝播している全身性の生理信号の混入も考慮しなければならない。
これらのノイズのうち,脈波,呼吸など,周期が規則的なものは問題なく取り除くことができる。一方で,周期的ノイズのうち自律的低周波振動と呼ばれる0.01-0.15Hz程度の波は,扱いが厄介である(図5)。この波は,心肺機能の揺らぎ由来の周期的な生理振動であることは分かっているが,生成のメカニズムは未だ不明である16)。
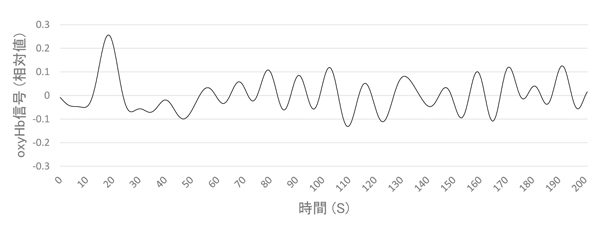
Go/Nogo課題遂行時の成人脳活動データから,0.01-0.1Hz帯域のデータを抽出し,時系列データとしてプロットしたもの。十数秒周期の緩やかな律動が観察できる。
自律的低周波振動の問題は,その周期がブロックデザインにせよ事象関連デザインにせよ認知課題の周期と干渉しやすいという点にある。脳の血流動態反応は標準的には血流が上昇して下降が終わるまでの1サイクルが16秒程度である。課題のサイクルはこれ以上の長さであることが多いため,自律的低周波振動と重なってしまうことがしばしばある。課題のサイクルが20秒以上の場合は,倍周期で重なる可能性も出てくる。
自律的低周波振動を回避するための明確な方法があるわけではない。まずは,課題周期をずらすという方法があるが,ノイズ軽減といった程度の効果である。このような場合,一般論にしたがって,ノイズのレベルが抑えがたい場合,シグナルを増やすことが有用である。
たとえば,われわれが行なっているADHD研究においては,抑制機能を調べるためにGo/Nogo課題を使っている3)。Go課題では,小児の被験者にPC画面に「どんな動物が出てもボタンを押して」と指示する。それに続くNogo課題では,「虎が出たらボタンを押して,でも象が出たらボタンを押さないで」と指示する。このときOxyHbについてNogo課題とGo課題の差分値を比較すると,右前頭前野の中前頭回と下前頭回の境界付近の限局された領域に脳の活動が観察できる(図6)。限局されている信号であれば,課題との特異性が高い脳活動であれという論理的判断が成り立つ。さらに過去のfMRI研究からもGo/Nogo課題における右前頭前野が活動することが分かっており,この点でも理にかなった脳活動であると言える。このように複数の根拠から妥当性が高いと判断できる脳活動をわれわれはニューロマーカーと呼んでいる。
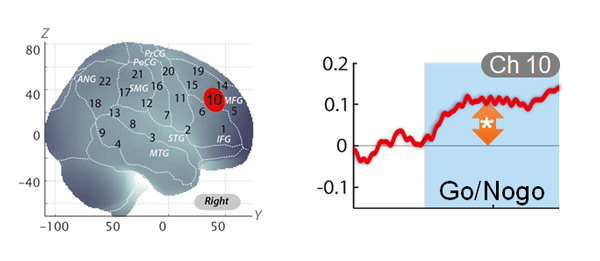
定型発達児がGo/Nogo課題を遂行している際の脳活動を示している。左は,標準脳座標系上での脳活動情報。右下前頭回(IFG)と右中前頭回(MFG)の間に位置しているチャネル(CH)10のみに有意な脳活動が見られる。右図は同じCH10の時系列データ。OxyHb信号の有意な上昇が,課題遂行時に観察できる。
課題と同期するさらにやっかいな信号は覚醒や緊張状態の変化である。これは交感神経の働きによって皮膚の血管が拡張するという反応だ。緊張を伴う課題には出やすいノイズである。この場合,脳の反応よりも早期に血流の変化が現れる。このノイズは,皮膚血流のすばやい変化であるため,送受光器間距離の短い配置を組み込むことによって取り除ける場合もあるが17),それ以前に,覚醒や緊張状態の変化を伴う課題設定を避けるという配慮が適切である。この皮膚血流変化は広い領域で現れるため,上記のように限局された活動であれば,特に問題が生じるわけでもない。この意味でも,頑健なニューロマーカーを見いだすことは,fNIRS研究を成功させる秘訣であると言える。
次回に続く-
1) M. Ferrari, V. Quaresima, A brief review on the history of human functional near-infrared spectroscopy (fNIRS) development and fields of application, Neuroimage 63, 921-35 (2012)
2) 檀一平太, fNIRSによる脳機能研究:スペクトロスコピーからイメージングへ, オプトロニクス, 3月号 (2019)
3) Y. Monden et al., Right prefrontal activation as a neuro-functional biomarker for monitoring acute effects of methylphenidate in ADHD children: An fNIRS study, Neuroimage Clin. 1, 131-40 (2012)
4) H. Yanagisawa et a., Acute moderate exercise elicits increased dorsolateral prefrontal activation and improves cognitive performance with Stroop test. Neuroimage. 50, 1702-10 (2010)
5) K. Kawabata-Duncan et al., Willingness-to-pay-associated right prefrontal activation during a single, real use of cosmetics as revealed by functional near-infrared spectroscopy. Front Hum Neurosci. 13, 16 (2019)
6) E. Okada E, D.T. Delpy, Near-infrared light propagation in an adult head model. II. Effect of superficial tissue thickness on the sensitivity of the near-infrared spectroscopy signal, Appl. Opt. 42, 2915-22 (2003)
7) H. Obrig, A. Villringer, Beyond the visible–imaging the human brain with light, J. Cereb. Blood Flow Metab., 23, 1 (2003).
8) H. Plassmann, et al., Orbitofrontal cortex encodes willingness to pay in everyday economic transactions, J. Neurosci. 27, 9984–88 (2007)
9) P. G. Haydon, G. Carmignoto, Astrocyte control of synaptic transmission and neurovascular coupling, Physiol. Rev., 86, 1009 (2006).
10) M. Uga et al., Optimizing the general linear model for functional near-infrared spectroscopy: an adaptive hemodynamic response function approach, Neurophotonics, 1, 015004 (2014)
11) T. Yamada et al., Separation of fNIRS signals into functional and systemic components based on differences in hemodynamic modalities, PLoS One. 7, e50271 (2012)
12) X. Cui et al., Functional Near Infrared Spectroscopy (NIRS) signal improvement based on negative correlation between oxygenated and deoxygenated hemoglobin dynamics, Neuroimage 49, 3039-46 (2010)
13) M. Cope et al., Methods of quantitating cerebral near infrared spectroscopy data, Adv. Exp. Med. Biol., 222, 183 (1988).
14) A. Maki et al., Spatial and temporal analysis of human motor activity using noninvasive NIR topography, Med. Phys., 22, 1997 (1995).
15) A. Katagiri et al., Mapping of optical pathlength of human adult head at multi-wavelengths in near infrared spectroscopy, Adv. Exp. Med. Biol. 662, 205-12 (2010)
16) Y. Tong tet al., Low frequency systemic hemodynamic “noise” in resting state BOLD fMRI: Characteristics, causes, implications, mitigation strategies, and applications. Front. Neurosci. 13, 787 (2019)
17) S. Brigadoi and R.J. Cooper, How short is short? Optimum source-detector distance for short-separation channels in functional near-infrared spectroscopy. Neurophotonics, 2, 025005 (2015)
Functional neuroimaging using fNIRS: from “spectroscopy” to “imaging”
Ippeita Dan
Professor, Applied Cognitive Neuroscience Laboratory, Faculty of Science and Engineering, Chuo University
【著者紹介】
檀 一平太(だん いっぺいた)
中央大学理工学部人間総合理工学科 教授
■略歴
1969年生まれ。国際基督教大学教養学部理学科生物学専攻卒業。東京大学大学院総合文化研究科博士課程中退。日本学術振興会特別研究員,科学技術振興事業団研究員,健康食品会社営業員等を経て,食品総合研究所に入所。PD,研究員,主任研究員,自治医科大学医学部先端医療技術開発センター脳機能研究部門准教授を歴任。
2013年より,中央大学理工学部人間総合理工学科教授。学術博士。キャリア初期の専門分野は分子生物学。その後,脳科学と食品科学の融合分野の開拓に従事し,fNIRS(近赤外分光分析法)の空間解析手法の確立,fNIRSによる味覚記憶に関する研究などの成果を挙げるとともに,ヒトの脳における認知構造を活用した食品開発法の探索を行った。現在の主な研究テーマは,fNIRSによる脳機能イメージング法の医療応用,fNIRSの空間解析手法の開発,および,サイコメトリクスによる食生活QoLの解析,マーケティング応用等。
2007年に味覚記憶の脳機能イメージング研究により安藤百福賞・発明発見奨励賞受賞。NEDO産業技術研究助成事業,生研センター新技術新分野創出のための基礎研究推進事業,JST-RISTEX等のプロジェクトリーダーに従事。
現在は,Neurophotonicsの創設エディター,SfNIRS理事,2020年fNIRS Conference共同大会長。また,中央大学研究開発機構にて,サイゼリヤ食認知科学研究ユニット長。英文有査読論文発表数100,被引用総数7400,h指数37。研究の傍ら,筑波山麓の里山にて菜園生活を営んでいる。趣味はロングボードサーフィン。
