
産業技術総合研究所
大崎寿久

情報理工学系研究科
教授 竹内昌治
3.ナノポアを利用した人工細胞膜センサ
前節で述べたような脂質二重膜形成デバイスは、標的となる膜タンパク質を脂質二重膜に再構成することで、膜タンパク質+脂質二重膜=人工細胞膜デバイスとして研究が進められるようになった。まず着目されたのは、膜タンパク質の機能解析への利用である7,10)。デバイスに電極を配置することで、特に膜タンパク質の中でもイオンチャネルを標的とした例は多く報告されるようになった。またイオンチャネルの機能解析によりデバイス開発が進んだことで、逆に膜タンパク質の優れた機能を活用したアプリケーションが提案されるようになり、中でもセンサ応用が注目されている11)。
人工細胞膜デバイスのセンサ研究で最初に広く用いられるようになったのは、生体ナノポアと呼ばれる脂質二重膜にナノメートルサイズの孔を作る膜タンパク質である。生体ナノポアとして代表的なアルファヘモリシンは、水溶液に可溶であり、脂質二重膜には自発的に再構成して最狭部が約1.4 nmのポアを膜に形成する。MEMS技術でも再現良く作ることが容易ではないナノサイズの貫通孔を、再現性高く簡単な操作で得られる点に魅力がある。ナノポアを使った人工細胞膜センサは、コールターカウンターのように、標的物質がポアを通過する際のイオン電流の変化にもとづいて検出を行う。アルファヘモリシンのように、ポアサイズがちょうど1本鎖DNAが透過できる程度であるナノポアは、DNAやRNAなどの核酸のシーケンシング技術へと発展し11)、また現在はタンパク質を構成するアミノ酸の識別へと研究が進んでいる12)。
ナノポアによる核酸検出では、生体ナノポアの閉塞に伴うイオン電流の低下によって、核酸1分子(1本)を観測する。竹内らは、ナノポアを閉塞しない小分子の計測技術として、DNAアプタマーとナノポアを利用することを提案した13)。DNAアプタマーとは、標的分子と特異的に結合する配列を持つことで、標的分子との複合体を形成するDNAのことである。標的分子がない場合、DNAアプタマーはナノポアを透過できるが、標的分子と複合体を形成するとナノポアを透過できず、閉塞が生じて電流が顕著に低下する(図5)。すなわち複合体を形成することにより、標的が小分子であってもその1分子を検出できる。このセンサは、DNAアプタマーが標的分子との特異性を保証し、ナノポアが1分子計測可能な信号増幅を担うことで、感度・選択性の両面に優れた特性を示すことができる。
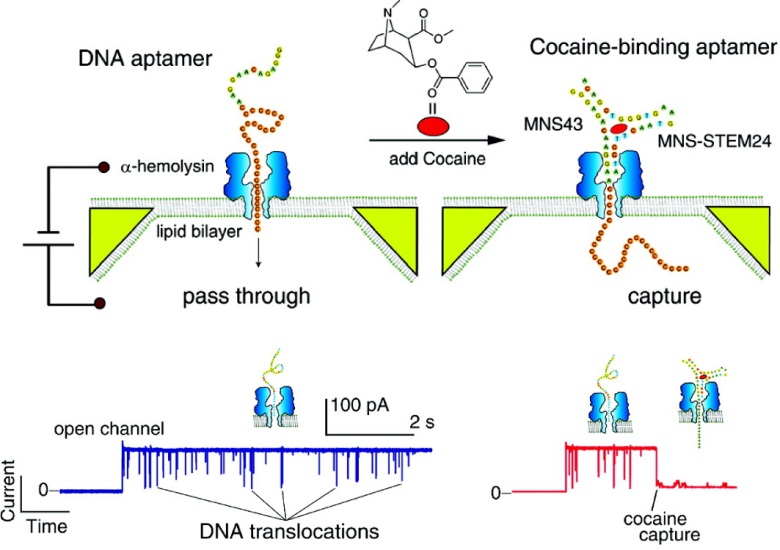
Adapted with permission from Ref. 13. Copyright 2011 American Chemical Society.
マイクロRNAは18-25塩基長の短いRNA鎖からなり、体内でタンパク質の発現制御などに関わることが明らかになってきており、近年、がんの診断マーカーとして注目されている。このマイクロRNAの特異的検出法として、脂質二重膜に対するナノポアの再構成をシグナルとして利用するセンサが提案されている14)。図6aに示すように、標的マイクロRNAに相補的な配列をもつDNAの末端に、磁気ビーズとアルファヘモリシン再構成リポソーム(脂質二重膜小胞)をそれぞれ結合したものを検出素子としている。スイッチとして2本鎖特異的切断酵素を用いることで、標的配列のマイクロRNAがあるときにのみ、アルファヘモリシン再構成リポソームが遊離し、脂質二重膜にナノポアを形成して電流シグナルを発生させる(図6b, c)。このセンサにおいてはDNAの相補的配列が標的特異性を担保し、100万種・10倍濃度の夾雑マイクロRNAに対しても偽陽性を示さないことが確認されている。このようにナノポアを利用した人工細胞膜デバイスでは、DNAなど生体分子の特異的相互作用と組み合わせることで優れたセンサが生み出されている。
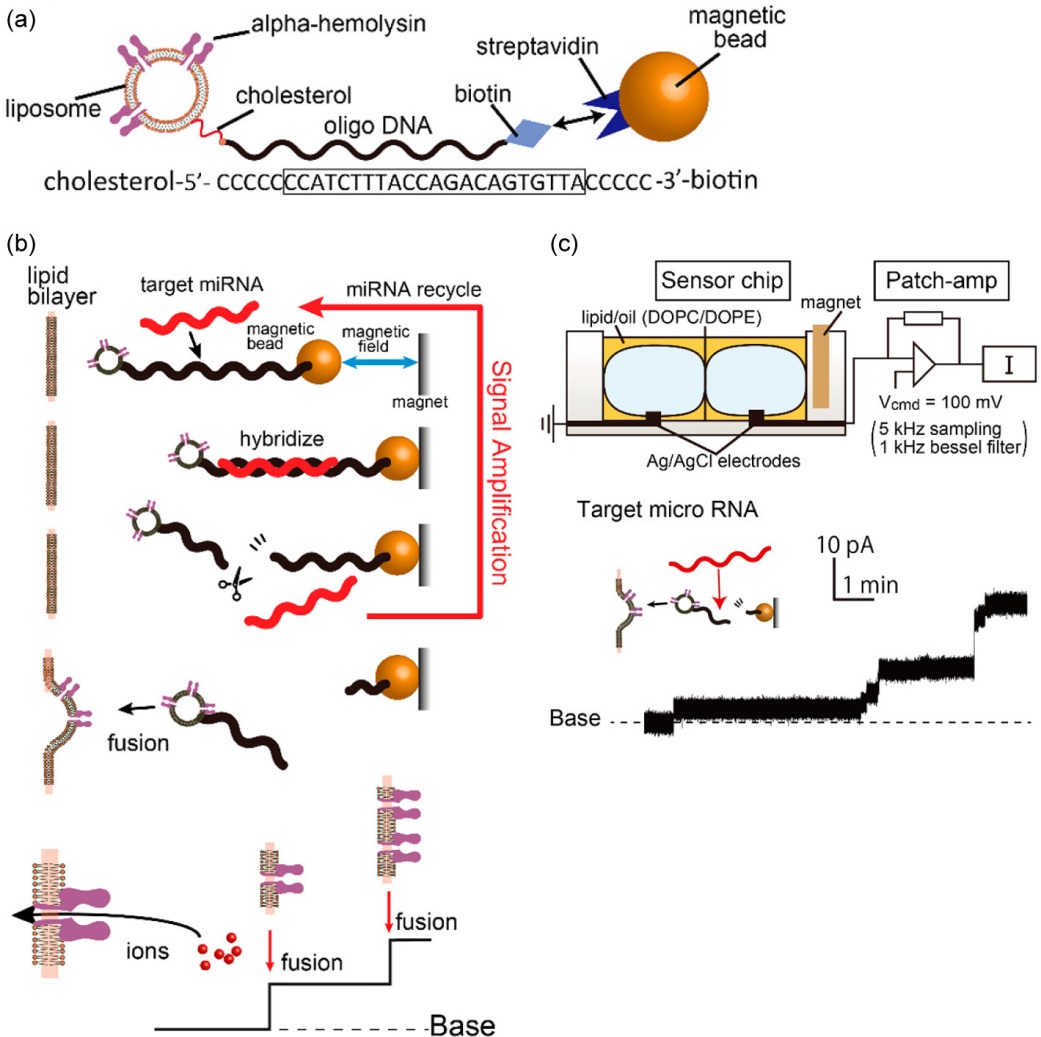
Adapted with permission from Ref. 14. Copyright 2018 American Chemical Society.
4.昆虫嗅覚受容体を利用した人工細胞膜センサ
前節のナノポアに対して、より高機能な膜タンパク質をもつ人工細胞膜センサの研究も近年行われるようになってきた。昆虫嗅覚受容体は、リガンド依存性陽イオンチャネルを形成すると考えられており、受容体にリガンド(匂い物質)が結合すると陽イオン電流を生じる。1分子の結合をピコアンペア程度に増幅することから、特異性・増幅率を併せ持つ優れた素子として匂いセンサへの活用が期待されている。
匂い物質は、その分子構造がもつ性質から親油性、水に難溶性のものが多い。液滴接触法を利用した人工細胞膜は、2つの油中水滴界面に脂質二重膜を形成しているため、このような匂い物質を水相に移行させることが難しく、匂いセンサデバイスには適さなかった。そこで、図7aに示すように2つのウェルの片側は水溶液(ゲル)のみとして脂質二重膜を形成し、匂いセンサへの適用可能性を検討した。まず、農薬の成分であるオメトエート(揮発性有機化合物)を標的分子として、前節のナノポアとDNAアプタマーの系を用いて検証したところ、100 ppbのオメトエートを気中から検出することに成功した15)。オメトエートが気中から自発的に水溶液中に溶解できたことで、アプタマーと複合体を形成し、ナノポアの閉塞現象によって検出できたと考えられる。
次に、このデバイスに対して蚊の嗅覚受容体を再構成した人工細胞膜センサを作製し、ヒトの汗の匂い成分の一つであるオクテノールを標的分子として検出を行った16)。人工細胞膜センサに再構成された嗅覚受容体は、オクテノールに対して矩形波状の電流応答を示すことが分かった。このセンサを用いて気中オクテノール10 ppbの検出を達成している。ここで用いた嗅覚受容体は、受容体自体が高い選択性をもつ。オクタノールやオクタノンなどの類似化合物と比較して、標的分子であるオクテノールに高い特異性を示すことが確認できた。この匂いセンサを搭載する無線・携帯型計測器を作製し、ロボットと連携させることで、匂い物質に応答するセンサシステムの開発も考えられる(図7b,c)。
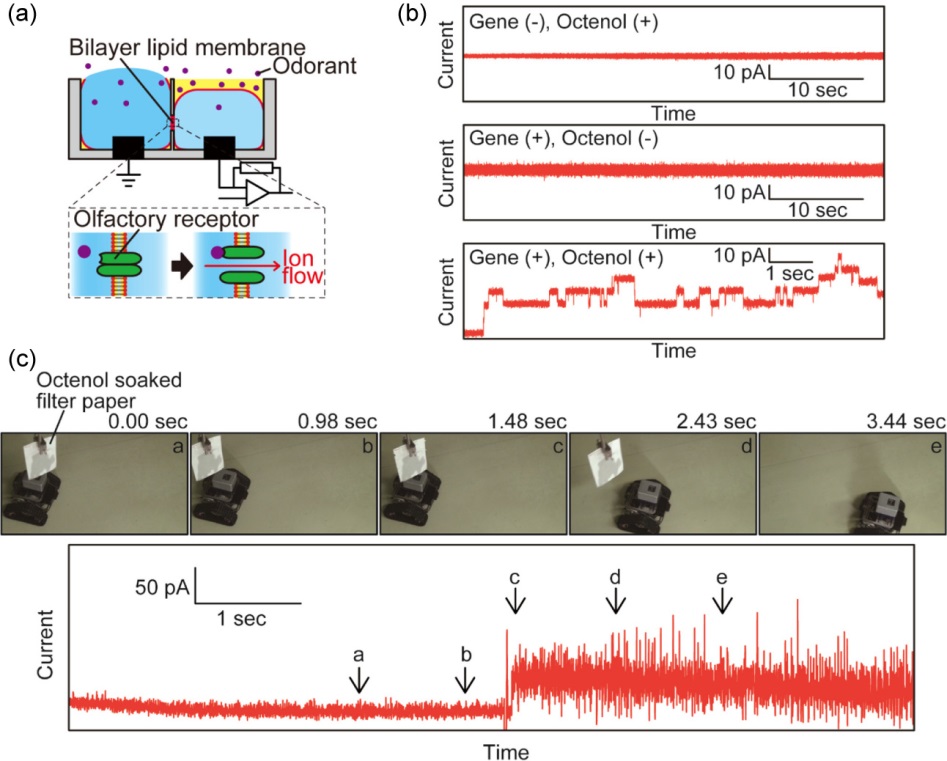
Adapted with permission from Ref. 16. Copyright 2019 American Chemical Society.
嗅覚受容体を利用した人工細胞膜センサは、現在その原理実証ができた段階にあり、感度や応答性のようなセンサとしての基本的性能の向上が求められる。上述のように、受容体は水溶液中で活性を示すが、一方で匂い物質の気中に対する水中の分配係数は低いことが多い。性能向上には、匂い物質の自発的な溶解を待つのではなく、積極的に溶解するための要素技術の開発が必要であろう。また、生物の嗅覚と同様に、複数種の嗅覚受容体を搭載したセンサによる複雑な匂いの認識など、今後のますますの研究展開が期待される。
5.まとめ
本稿では、細胞膜を生体外で再現するために研究されてきたデバイス技術と、そうしたデバイス上で活用されるようになった人工細胞膜のセンサ応用について紹介した。これまで人工細胞膜センサの研究は、ナノポアや膜タンパク質に関わるような、センサの核となる検出原理について集中して行われてきた。今後、実用化を意識した周辺技術への研究の広がりが待たれる。特に生体分子に由来する保存・寿命や品質管理・較正といった課題への取り組みは、人工細胞膜センサに限らず、バイオと人工物のハイブリッド型デバイスの実用化においては不可欠である。こうした要素技術が集約され、人工細胞膜センサのプラットフォームが早期に確立されることが期待されている。
7) R. Kawano, Y. Tsuji, K. Sato, T. Osaki, K. Kamiya, M. Hirano, T. Ide, N. Miki and S. Takeuchi, Sci. Rep., 2013, 3, 1995.
10) K. Kamiya, T. Osaki, K. Nakao, R. Kawano, S. Fujii, N. Misawa, M. Hayakawa and S. Takeuchi, Sci. Rep., 2018, 8, 17498.
11) N. Misawa, T. Osaki and S. Takeuchi, J. R. Soc. Interface, 2018, 15, 20170952.
12) S. Howorka and Z. S. Siwy, Nat. Biotechnol., 2020, 38, 159-160.
13) R. Kawano, T. Osaki, H. Sasaki, M. Takinoue, S. Yoshizawa and S. Takeuchi, J. Am. Chem. Soc., 2011, 133, 8474-7.
14) S. Fujii, K. Kamiya, T. Osaki, N. Misawa, M. Hayakawa and S. Takeuchi, Anal. Chem., 2018, 90, 10217-10222.
15) S. Fujii, A. Nobukawa, T. Osaki, Y. Morimoto, K. Kamiya, N. Misawa and S. Takeuchi, Lab Chip, 2017, 17, 2421-2425.
16) N. Misawa, S. Fujii, K. Kamiya, T. Osaki, T. Takaku, Y. Takahashi and S. Takeuchi, ACS Sensors, 2019, 4, 711-716.
【著者紹介】
大崎 寿久(おおさき としひさ)
神奈川県立産業技術総合研究所 人工細胞膜システムグループ サブリーダー
■略歴
2002年 東京工業大学大学院理工学研究科 博士課程修了
2002年 ライプニッツ高分子研究所 博士研究員
2006年 産業技術総合研究所 特別研究員
2007年 東京大学生産技術研究所-LIMMS/IIS-CNRS CNRS博士研究員
2009年 神奈川県立産業技術総合研究所 サブリーダー、現在に至る
専門は界面物理化学、高分子材料科学。2007年より、細胞膜をマイクロチップ中で再構成するためのプラットフォーム技術に関する研究に従事。近年は膜タンパク質機能解析やそのセンサ応用について実用化研究を進めている。
竹内 昌治(たけうち しょうじ)
東京大学 大学院情報理工学系研究科 教授
■略歴
2000年 東京大学大学院工学系研究科 博士課程修了
2000年 日本学術振興会 特別研究員
2001年 東京大学生産技術研究所 講師
2003年 同 助教授(2007年より准教授)
2014年 同 教授(2019年より兼務)
2019年 東京大学情報理工学系研究科 教授
この間、2004-2005年 ハーバード大学化学科 客員研究員、ほか
専門はバイオハイブリッドMEMS。3次元組織構築、体内埋め込み型デバイス、人工細胞膜、培養肉などのプロジェクトに従事。

