
教授 桑原 義彦
5. UWBレーダを用いた臨床試験(14)
5.1 撮像装置
開発した撮像装置の外観と構成を図6に示す。装置は複数のアンテナから構成される撮像センサー、乳房を撮像センサーに吸引固定するアスピレータ、送受信機となるVNA(Agilent E5071C)、複数のアンテナの入出力を選択制御してVNAに接続するアンテナスイッチ、制御用のPC及び画像再構成に用いるWSから構成される。試作装置の大きさは600mm(幅)×600mm(長さ)×500mm(高さ)で、診察室に設置したベットと接続して使用する。
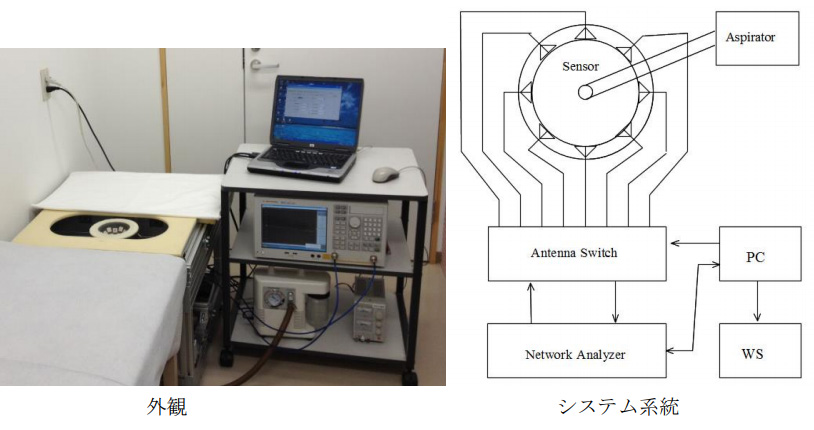
図7にセンサーの詳細を示す。センサーは脂肪組織とほぼ同じ電気定数を持つ半球の樹脂製のカップに複数のスロット給電のスタックパッチアンテナが埋め込まれている。カップの頂点にアスピレータに接続するためのバルブが設けられ、下面は乳房を入れるため開口している。アンテナは皮膚と密着した時に4~9GHzで整合するように設計されている。
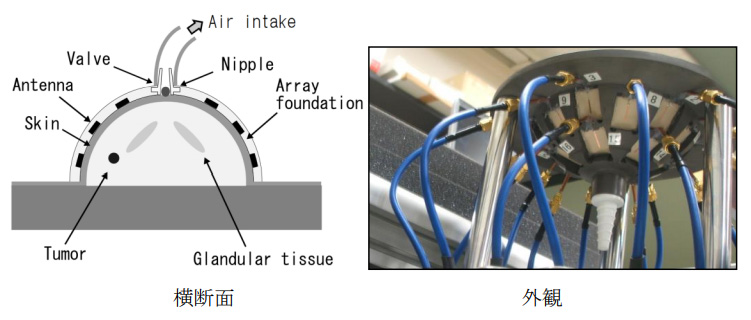
欧米で試作された臨床撮像装置の多くは、乳房を整合液に浸す必要があった。時分割受信方式で散乱応答の受信データ群を収集する場合、数秒~数分程度を要する。その間に呼吸や体動で乳房が動くと、正しいデータが取得できず、撮像に失敗する。筆者らの開発した装置では乳房は撮像センサー内に固定されるので、撮像ミスを防ぐことができる。いろいろな形や大きさの乳房を撮像するため、直径13cm深さ5.5cm、直径10cm深さ4cm、直径8cm深さ2cmの3種類のセンサーを用意した。実装されているアンテナの数はそれぞれ30、18、6である。
5.2 撮像方法
撮像の前に適切なサイズのセンサーを選択する。被検者は図8に示すようにうつ伏せになって乳房をセンサーに入れる。そして吸引が開始される。吸引して乳房がアンテナと密着すると反射損失(S11)が低下するので、S11を順次測定し、密着が良好であることを確認する。密着が正常であれば、図9に示すように該当するアンテナに対応した表示が白色に、密着が不良であれば赤色になる。密着が異常な場合、S11が充分に下がるように、センサーの位置や体位を変える。密着の確認後、撮像を開始する。臨床試験ではアレー回転法によりアーチファクトを除去したため、センサーを20°回転させ、改めて密着を確認してからもう一度測定した。1回の測定時間は6、18、30素子の撮像センサーについてそれぞれ6、30、300秒である。

5.3 臨床撮像結果
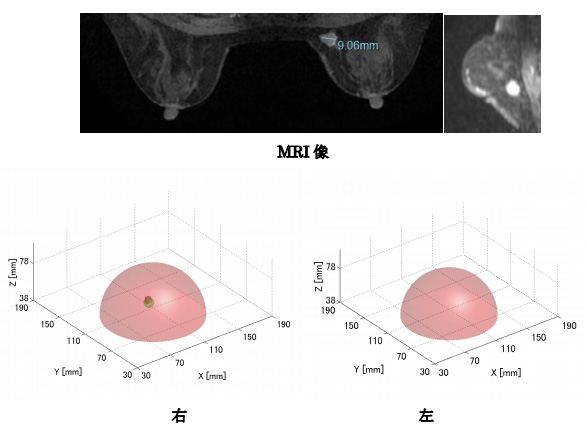
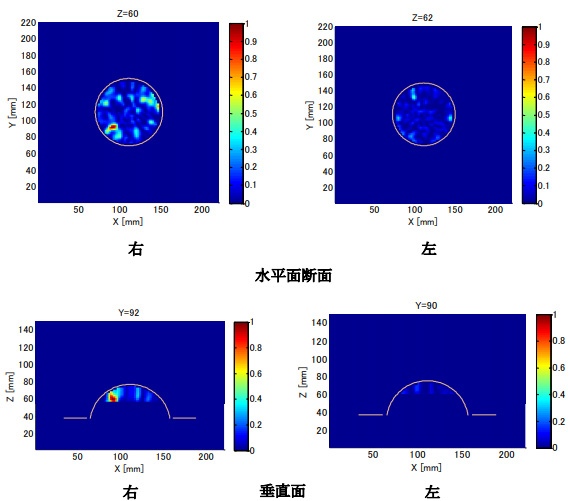
7名のがん患者について臨床撮像を実施した。このうち6名について正しくデータが取得できた。代表的な撮像結果を紹介する。後方散乱は癌のある付近で最も強くなるので、がんのある乳房の測定で得られた最大散乱強度で規格化した画像を示す。3次元表示について、MRI像から推定した癌の大きさと位置を薄いグリーンの領域で示し、最大散乱強度の70%以上の分布を示した。本例では6素子の撮像センサーを用い、撮像アルゴリズムはMISTを用いた。
撮像結果を図10に示す。患者は50代の女性で、右胸の内側下方の胸壁近くに直径9mmの初期癌が認められる。癌の周りには腺組織が存在しない。MIにより3次元像、断層像とも癌の位置に強い反射像が確認できた。健康な胸では大きな反射像は認められない。
5.4 UWBレーダの課題
がん患者の臨床撮像では、いずれのがん患者ともがんの周りに強い散乱像が認められた。しかし、特に大きな進行がんでは、散乱像の形はがんの形状、大きさを反映していなかった。図10の例では、がんのある乳房の散乱強度の最大値で再構成画像を規格化することにより、がんの応答を際立たせることができた。しかし、実際の検診で健康な乳房を撮像した場合、最大散乱強度で再構成画像を規格化しても、散乱が強い領域にがんがあるかないかが判断できない。がんとそれ以外の組織を識別する手段として、磁気ナノパーティクルをがんに取り込ませる方法が提案されているが(15)、実証試験にはいたっていない。
6. 逆散乱トモグラフィの実現に向けて
4.2(2)で逆散乱トモグラフィの実現に向けた課題を示した。筆者らはこれらの課題の解決に向け次の方法を検討している。
a. モデル化誤差が出にくい形状のセンサー
b. 2で述べた乳房組織の複素誘電率に関する予備知識の活用
c. 高感度で簡単な構造の自己補対パッチアンテナの適用
d. アンテナの交差配置による、撮像センサーの小型化と観測データの多様化の両立。
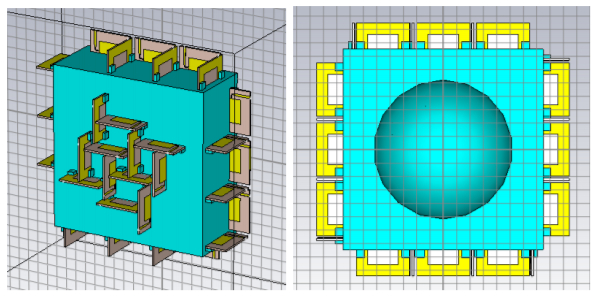
これらの対策を適用して設計した撮像センサーの外観を図11に示す。また、計算機シミュレーションによって数値ファントムの比誘電率と導電率を再構成した画像を図12に示す。上段は比誘電率、下段は導電率の3次元分布で、左側は元の分布、右側は再構成した分布を示す。乳房の右にある白い部分が図10のがんの領域に相当する。設計した撮像センサーによりがんや乳腺の組織像が正確に再構成されていることがわかる。

7. 終わりに
MIによる乳房内イメージングの技術について概説した。本技術は四半世紀にわたり欧米を中心に研究されてきたが、いまだ実用に至っていない。UWBレーダでは、がんと正常組織の識別技術、逆散乱トモグラフィでは、モデル化誤差や測定誤差の低減が、実現に向けた最大の課題である。UWBレーダでのがんと正常組織の識別は、磁気ナノパーティクルの活用のほか、機械学習の活用が提案されている(15)。また、波頭再構成や超分解法を用いた場合、従来のDASやビームフォーミング法よりSNRが改善し、がんの領域も正しく表示できるという報告もある(7)(12)。逆散乱トモグラフィについては近年目立つ研究成果が発表されていない。著者らは図11の撮像センサーを現在試作しており、その評価結果については別の機会で紹介したい。
参考文献
7) A. Fasoula, B. M. Moloney, L. Duchenene, J. D. Gil Cano, B. L. Oliveria, J-G. Bernard, and M.J. Kerin, “Super resolution radar imaging for breast cancer detection with microwaves: the integrated information selection criteria,” Proc. of EMB2019, 2019.
14) Y. Kuwahara, S. Miura, Y. Nishina, K. Mukumoto, H. Ogura, and H. Sakahara, “Clinical Setup of Microwave Mammography,” IEICE Trans. Vol. EB96, No.10 pp.2553-2562, 2013.
15) G. Bellizzi, O.M. Bucci, I. Catapano,“Microwave cancer imaging exploiting magnetic nanoparticles as contrast agent”, IEEE Trans. on Biomed. Eng., vol.58, no.9, pp.2528-2536, 2011.
16) T. Reimer1, J. Sacristan1, and S. Pistorius, “Improving the Diagnostic Capability of Microwave Radar Imaging Systems using Machine Learning,” Proc. of 2019 EUCAP.
【著者紹介】
桑原 義彦(くわはら よしひこ)
静岡大学 工学部 電気工学科 教授
■略歴
1978 慶大・工・電気卒、同年日本電気(株)入社
1999 静岡大学工学部助教授
2006 同大教授、現在に至る
工学博士
アンテナ・電波伝搬、航空電子機器、移動通信システム、アレー信号処理、ワイヤレス送電、マイクロ波イメージングの研究開発に従事
1988 防衛装備協会賞
1997、1999電波功績賞受賞 IEEE会員

